Class 12 Chemistry Chapter 6 हैलोएल्केन तथा हैलोऐरीन Part 4 हैलोएल्केन तथा हैलोऐरीन अथवा Heloelken tatha heloerin का ही एक अहम् भाग है | अगर आप इस इकाई अथवा पाठ को अच्छे से अध्ययन करना चाहते है तो हम आपसे यही अनुरोध करते है कि आप इस बहुत बड़ी इकाई को छोटे छोटे part में पढ़े | यही वजह है कि हम आपको यहाँ पर part वाइज नोट्स Provide कर रहे है | इस part में जो भी महत्वपूर्ण हैडिंग है उन्हें जरूर याद करे | क्यूंकि ये ही आपको अच्छे मार्क्स प्राप्त करने में मदद करेंगी |
Table of Contents
ToggleIf you need online tutor or help for any questions like mathematics, physics, chemistry numerical or theory then you can contact me on WhatsApp on +918755084148 or click here. Our team help you all time with cheap and best price. If need it on video our team provide you short video for your problem. So keep in touch of our team specialists.
Class 12 Chemistry Chapter 6 हैलोएल्केन तथा हैलोऐरीन Part 4
Class 12 Chemistry Chapter 6 हैलोएल्केन तथा हैलोऐरीन Part 4 में हम बोर्ड में पूछे गये कम से कम 3 से 5 मार्क्स का अध्ययन करेंगे | अत: आप इन्हें ध्यान से पढ़े | अगर आप कुछ समस्या महसूस करते है तो आप हमे सम्पर्क कर सकते हो और आप Ask Question पर क्लिक करके प्रश्न भी पूछ सतके हो | हम आपसे ये गुजारिश करते है कि आप इन महत्वपूर्ण हैडिंग को अवस्य याद करेंगे | क्यूंकि ये वो सभी हैडिंग है जो पिछले बहुत सालो के पेपर में रिपीट हुई है | अगर आप इन्हें याद करके एग्जाम में बैठते है तो आप 90 % से अधिक अंक हासिल कर सकते है |
Class 12 Chemistry Chapter 6 हैलोएल्केन तथा हैलोऐरीन Part 4 में महत्वपूर्ण Headings निम्नलिखित है | इन्हें अच्छे से याद करे | ये आपको अच्छे अंक दिलाने में मदद करेगी:
- हेलोफॉर्म परीक्षण और इसके उपयोग
- टेट्रा हेलो एल्केन और इसकी निर्माण विधियाँ
- टेट्रा हेलो एल्केन के भौतिक, रासायनिक गुण और उपयोग
- फ्रीऑन और इसकी निर्माण विधियाँ
- फ्रीऑन के गुण व उपयोग
- डी0 डी0 टी0 और इसकी निर्माण विधियाँ
- डी0 डी0 टी0 के गुण व उपयोग
- हेलो एरिन और IUPAC पद्धति में इसका नामकरण
- हेलो एरिन के निर्माण की विधियां
- बाल्ज- शीमान अभिक्रिया, सैंडमायर अभिक्रिया, गाटर मान अभिक्रिया , हुन्सडीकर अभिक्रिया
- हेलो एरिन के भौतिक और रासायनिक गुण
- एरिल हैलाइड की इलेक्ट्रो स्नेही प्रतिस्थापन अभिक्रियाएं और बेंजीन की o/p प्रतिस्थापन की प्रवृत्ति
- हेलोएरिन में C- X आबंध की प्रकृति और अनुनाद प्रभाव
- हेलोएरिन में हैलोजन परमाणु के कारण अभिक्रियाएं
- हेलोएरिन की अन्य अभिक्रियाएं जैसे उलमान अभिक्रिया और उपयोग
- क्लोरो बेंजीन और इसकी निर्माण विधियाँ
- क्लोरो बेंजीन भौतिक और रासायनिक गुण
- क्लोरो बेंजीन के उपयोग

हेलोफॉर्म परीक्षण और इसके उपयोग
हेलोफॉर्म परीक्षण: वे सभी योगिक जिनमें -COCH3 समूह उपस्थित होता है। या वे योगिक जिनमें यह समूह ऑक्सीकरण के कारण उत्पन्न हो जाता है। उनको हैलोजन तथा कास्टिक क्षार के विलयनों के साथ गर्म करने पर ट्राई हेलो मेथेन(CHX3) सूत्र के योगिक बनते हैं जिन्हें हेलोफॉर्म कहते हैं।
इनमें क्लोरोफॉर्म व ब्रोमोफॉर्म रंगहीन द्रव है जिसके कारण इनके बनने का पता नहीं चलता है, जबकि आयोड़ोंफार्म एक विशेष गंध युक्त पीला ठोस पदार्थ होता है। अत: इसका बनने का पता चल जाता है इस प्रकार इस परीक्षण का उपयोग आयोड़ोंफार्म परीक्षण के रूप में होता है।
यह परीक्षण निम्नलिखित योगिक देते हैं:
1: प्राथमिक एल्कोहल में केवल एथेनॉल यह अभिक्रिया देता है।
2: सभी द्वितीय एल्कोहल जिनमें – OH समूह दूसरे कार्बन पर होता है हेलोफॉर्म बनाते हैं।
3: एल्डिहाइड में केवल एसिटिकएल्डिहाइड हेलो फॉर्म बनाता है।
4: सभी कीटोन जिनमें कीटो समूह दूसरे कार्बन पर होता है वह हेलोफॉर्म बनाते हैं।
अतः वे सभी योग जिनके पास CH3- CO- समूह या तो हो या वे ऑक्सीकरण के बाद इसे दे सकते हैं हेलोफॉर्म प्रशिक्षण देते हैं।
IMG====1

टेट्रा हेलो एल्केन और इसकी निर्माण विधियाँ
टेट्रा हेलो एल्केन: वे हेलोएल्केन जिनमें चार हेलोजन परमाणु एल्केन के किसी कार्बन से सीधे जुड़े होते हैं। टेट्रा हेलो एल्केन कहलाते हैं। जैसे कार्बन टेट्राक्लोराइड।
कार्बन टेट्राक्लोराइड:
अणु सूत्र: CCl4
IUPAC नाम: टेट्राक्लोरो मेथेन
यह मेथेन के सभी चार हाइड्रोजन परमाणु को चार क्लोरीन परमाणुओं के द्वारा प्रतिस्थापित करने पर प्राप्त होता है।
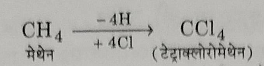
क्योंकि यह अग्नि को बुझा देता है अतः इसको पाईंरीन भी कहते हैं।
निर्माण विधियां:
1: मेथेन से: मेथेन को 673 केल्विन पर यह सूर्य के प्रकाश की उपस्थिति में क्लोरीन के अधिक्य से अभिक्रिया करने पर अशुद्ध कार्बन टेट्राक्लोराइड प्राप्त होता है ।
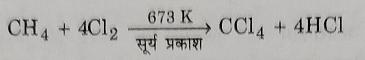
2: क्लोरीन की कार्बन डाईसल्फाइड पर अभिक्रिया से: यह कार्बन टेट्राक्लोराइड प्राप्त करने की औद्योगिक विधि है । इसमें कार्बन डाइ सल्फाइड तथा क्लोरीन की अभिक्रिया उचित उत्प्रेरक की उपस्थिति में (जैसे आयरन, आयोडीन, अल्युमिनियम क्लोराइड ,आदि ) कराई जाती है, जिसमें सल्फर मोनो क्लोराइड बनते हैं।
S2Cl2 पुन: CS2 से अभिक्रिया करके कार्बनटेट्राक्लोराइड बनाते हैं।
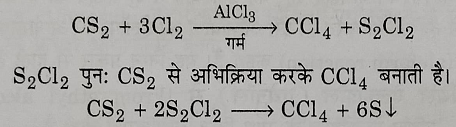
इस अभिक्रिया से प्राप्त मिश्रण का प्रभाजी आसवन करने पर कार्बन टेट्राक्लोराइड प्राप्त होता है। इस अशुद्ध कार्बन टेट्राक्लोराइड को सोडियम हाइड्रोक्साइड विलयन से धोकर इसका पुनः आसवन करने पर अत्यंत शुद्ध कार्बन टेट्राक्लोराइड प्राप्त होता है।
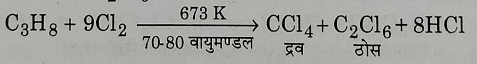
3: प्रोपेंन से : प्रोपेन तथा क्लोरीन की 673 केल्विन तापमान तथा 70 से 80 वायुमंडलीय दाब पर अभिक्रिया करने पर कार्बन टेट्राक्लोराइड द्रव तथा ठोस हेक्सा क्लोरो एथेन प्राप्त होता है।
Img।।।।।====5
4: क्लोरोफॉर्म के क्लोरीनीकरण से:

टेट्रा हेलो एल्केन के भौतिक, रासायनिक गुण और उपयोग
भौतिक गुण:
1: यह एक रंगहीन, विशिष्ट मीठी गंध वाला भारी द्रव होता है।
2: इसका क्वथनांक 350 केल्विन होता है।
3: यह पूर्ण रूप से अज्वलनशील तथा जहरीला पदार्थ होता है।
4: यह वास, तेल , मॉम आदि के लिए अच्छा विलायक होता है।
5: यह एक चतुष्कफलकीय अणु होता हैं।
रासायनिक गुण:
1: अज्वलनशीलता: क्योंकि यह पूर्ण रूप से अज्वलनशील है इसलिए इसका उपयोग अग्नि बुझाने वाले उपकरणों में किया जाता है।
2: स्थायित्व: कार्बन टेट्राक्लोराइड लगभग 773 केल्विन तक स्थाई रहता है लेकिन जब इसकी वाष्प को 773 केल्विन पर जलवाष्प के संपर्क में लाते हैं तो यह अपघटित होकर जहरीली गैस फॉस्जीन बनाता है।

3: क्षारीय जल अपघटन: इसका क्षारीय जल अपघटन करने पर पोटेशियम कार्बोनेट पदार्थ प्राप्त होता है।
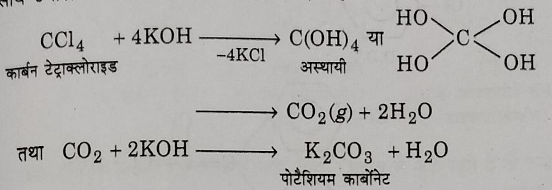
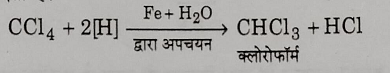
4: अपचयन: नम आयरन चूर्ण के द्वारा अपचयन करने पर यह क्लोरोफॉर्म में परिवर्तित हो जाता है।
5: राईमर टीमैन अभिक्रिया: जब कार्बन टेट्राक्लोराइड को सोडियम हाइड्रोक्साइड की उपस्थिति में फिनोल के साथ गर्म किया जाता है तो सैलिसिलिक अम्ल बनता है। यह अभिक्रिया राईमर टीमैन अभिक्रिया कहलाती है।
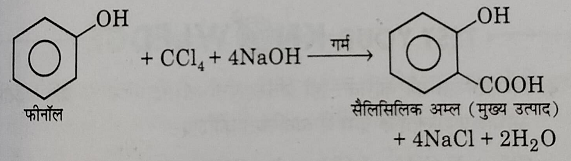
उपयोग:
1: अज्वलनशीलता: क्योंकि यह पूर्ण रूप से अज्वलनशील है इसलिए इसका उपयोग अग्नि बुझाने वाले उपकरणों में किया जाता है।
2: शुष्क धूलाई में विलायक के रूप में
3: दवाई और कीटनाशक के रूप में
4: वास तेल मॉम और रीजन के लिए उचित विलायक के रूप में
5: फ्रीऑन 12 के निर्माण में
फ्रीऑन और इसकी निर्माण विधियाँ
फ्रीऑन: एल्कानो के पॉलीक्लोरोफ्लोरो व्युत्पन्न को फ्रीऑन कहते हैं जैसे पाली क्लोरोफ्लोरोमीथेन और पाली क्लोरोफ्लोरोएथेन महत्वपूर्ण फ्रीऑन है ।

सामान्य निर्माण विधियां: इसका निर्माण टेट्राक्लोरो मेंथेन या परक्लोरोएथेन की SbCl5 उत्प्रेरक की उपस्थिति में HF से अभिक्रिया करके किया जाता है।
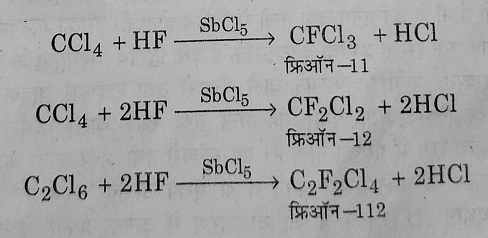
फ्रीऑन के गुण व उपयोग
फ्रीऑन के गुण व उपयोग:
1: यह रंगहीन, गांधहीन विषहीन अत्यंत अक्रिय तथा कम क्वथनांक वाला द्रव होता है।
2: यह बहुत कम दाब पर गैस अवस्था में परिवर्तित हो जाता है इस कारण इसका उपयोग रेफ्रिजरेटर तथा वातानुकूलन में प्रशितक के रूप में होता है।
3: हवाई जहाज में भी एरोसॉल नोदक के रूप में इसका उपयोग होता है।
4: इसका उपयोग विलायक के रूप में भी किया जाता है।
5: इनका पर्यावरण पर विनाशकारी प्रभाव पड़ता है क्योंकि यह ओजोन परत को नष्ट करने के लिए उत्तरदाई माना जाता है।
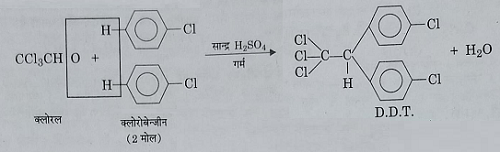
डी0 डी0 टी0 और इसकी निर्माण विधियाँ
डी0 डी0 टी0: प्रथम क्लोरीनिकृत कार्बनिक कीटनाशी डीडीटी का मूलत: सन 1872 में निर्माण किया गया था, परंतु इसके कीटनाशी प्रभाव की खोज सन 1939 में स्विट्जरलैंड के गिगी औषधालय में वैज्ञानिक पाल मूलर ने की थी।
इसका पूर्ण रूप p, p – डाई क्लोरो, डाई फ़ेनिल, ट्राई क्लोरोएथेन होता है। जिसे शॉर्ट में D.D.T कहते है ।
इसका संरचना सूत्र निम्नलिखित है:
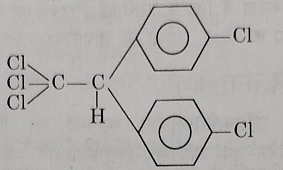
निर्माणविधि: जब क्लोरो बेंजीन के दो अणुओं को क्लोरल के एक अणु के साथ सांद्र सल्फ्यूरिक अम्ल या निर्जल जिंक क्लोराइड की उपस्थिति में गर्म करते हैं तो D.D.T प्राप्त होता है।
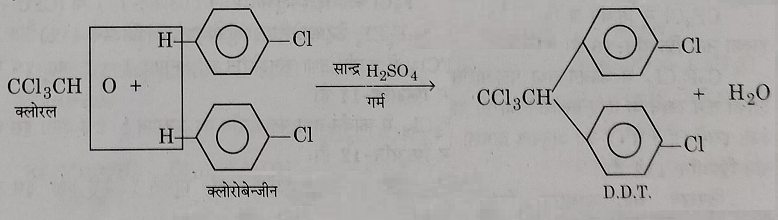
फ्रीऑन के गुण व उपयोग
गुण व उपयोग:
1: यह एक सफेद चूर्ण होता हैं।
2: यह जल में अविलय तथा तेलों में विलय होता है।
3: इसका गलनांक 383 केल्विन होता है।
4: यह सस्ता व प्रभावित कीटनाशक पदार्थ होता है।
5: इसका उपयोग मुख्यतः मलेरिया फैलाने वाले मच्छरों तथा टाइप्स वाहक जुओ की रोकथाम के लिए किया गया।
6: यह गाने तथा खाने वाली फसलों के लिए कीटनाशक के रूप में प्रयुक्त होते हैं।
हेलो एरिन और IUPAC पद्धति में इसका नामकरण
हेलो एरिन : एरोमेटिक हाइड्रोकार्बन के हैलोजन व्युत्पन्न को हेलो एरिन कहते हैं।
1: IUPAC नामकरण: इस पद्धति में इनका नामकरण निम्न प्रकार से किया जाता है:
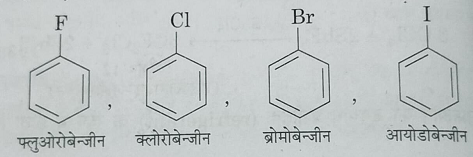
1: जब हैलोजन परमाणु सीधा बेंजीन वलय से जुड़ा होता है तो हैलोजन परमाणु को पूर्वलग्न के रूप में लिखकर बाद में बेंजीन शब्द जोड़ देते हैं।
2: जब दो समान हैलोजन परमाणु बेंजीन वलय से जुड़े होते हैं तो उन्हें वलय में स्थिति अनुसार पूर्वलग्न द्वारा दर्शाते हैं।
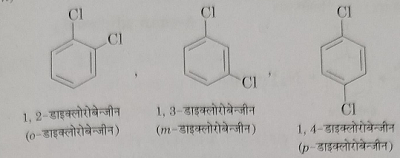
3: यदि दो आसमान हेलेन परमाणु बेंजीन वलय से जुड़े रहते हैं तो उन्हें अंग्रेजी वर्णमाला के क्रम में उनके वलय में स्थिति के अनुसार नामकरण देते हैं।
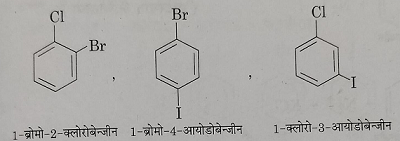
4: यदि बेंजीन वलय से दो या दो से अधिक हैलोजन परमाणु जुड़े रहते हैं तो उनकी बेंजीन वलय में स्थित संख्या लिखकर प्रदर्शित करते हैं।
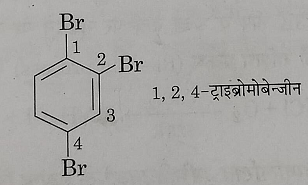
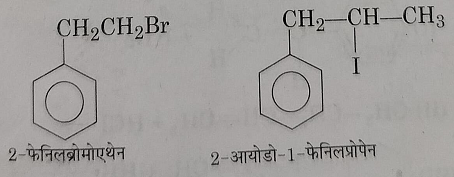
5: कुछ अन्य उदाहरण:
हेलो एरिन के निर्माण की विधियां
हेलो एरिन के निर्माण की विधियां: इनका निर्माण निम्न विधि द्वारा किया जा सकता है:
1: एरिन के सीधे हैलोजेनिकरण से: जब एरोमेटिक हाइड्रोकार्बन को किसी हैलोजन वाहक अथवा लुइस अम्ल जैसे निर्जल AlCl3, FeBr3, FeCl3 आदि की उपस्थिति में साधारण ताप पर सीधे हैलोजनीकृत किया जाता है तो हेलो एरिन प्राप्त होते हैं।
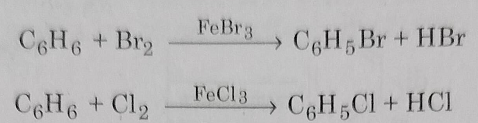
क्लोरीनीकरण या ब्रोमीनीकरण से नाभिकीय प्रतिस्थापन उत्पाद की प्राप्ति बहुत अच्छी मात्रा में होती है जबकि आयोडीन के साथ में नहीं।
बाल्ज- शीमान अभिक्रिया, सैंडमायर अभिक्रिया, गाटर मान अभिक्रिया , हुन्सडीकर अभिक्रिया
2: डाईएजोनियम (- N2X) समूह के हैलोजन द्वारा: यह अभिक्रिया प्रतिस्थापन विधि से होती है। इसमें प्रतिस्थापन निम्न प्रकार से किया जा सकता है:
अ) फ़्लुऑरिन द्वारा प्रतिस्थापन: जब डाईएजोनियम लवण को हाइड्रो फ़्लुऑरो बोरिक अम्ल से अभिक्रिया करके प्राप्त बेंजीन डाईएजोनियम ब्रोमो फ़्लुऑराइड को गर्म करते हैं तो फ़्लुऑरो बेंजीन प्राप्त होते हैं। यह अभिक्रिया बाल्ज- शीमान अभिक्रिया के नाम से जानी जाती है। यहां इस अभिक्रिया में डाईएजोनियम लवण अस्थाई यौगिक है जिसको एनिलीन के डाईएजोटीकरण द्वारा विलयन के रूप में प्राप्त करते हैं।
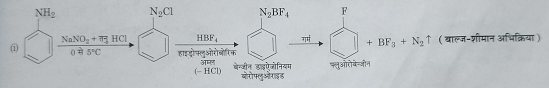
ब) क्लोरीन या ब्रोमीन द्वारा प्रतिस्थापन: जब डाईएजोनियम लवण के विलयन को क्रमशः क्यूप्रस क्लोराइड को HCl में खोलकर तथा क्यूप्रस ब्रोमाइड को HBr में घोलकर अभिकृत कराते हैं तो क्रमशः क्लोरो बेंजीन और ब्रोमो बेंजीन प्राप्त होते हैं ।इस अभिक्रिया को सैंडमायर अभिक्रिया कहते है ।
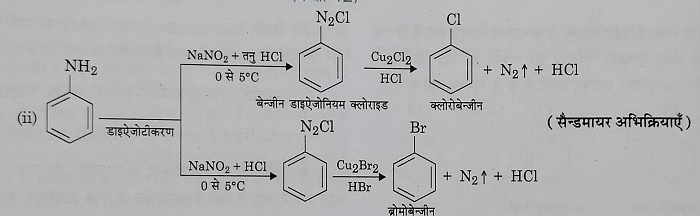
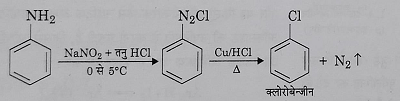
स) जब बेंजीन डाईएजोनियम क्लोराइड को कॉपर चूर्ण के साथ क्रमशः HCl व HBr की उपस्थिति में गर्म करते हैं तो क्रमशः क्लोरो बेंजीन और ब्रोमो बेंजीन प्राप्त होते हैं। इस अभिक्रिया को गाटर मान अभिक्रिया कहते हैं।
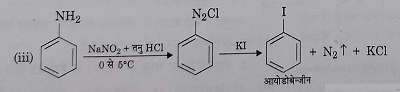
द) आयोडीन द्वारा प्रतिस्थापन: डाईएजोनियम लवण का पोटैशियम आयोडाइड के साथ अपघटन करके आयोडो बेंजीन प्राप्त किए जाते हैं।
3: हुन्सडीकर अभिक्रिया: जब एरोमेटिक कार्बाॅक्सीलिक अम्लों के रजत लवणों को ब्रोमीन के साथ CCl4 ब्लैक की उपस्थिति में अधिकृत कराया जाता है तो उनके ब्रोमो व्युत्पन्न प्राप्त होते हैं। यह अभिक्रिया हुन्सडीकर अभिक्रिया कहलाती है प्राप्त ब्रोमो यौगिक में मूल रजत लवण की अपेक्षा एक कार्बन काम होता है।

इस अभिक्रिया में क्लोरीन से अभिक्रिया करने पर कम मात्रा में क्लोरो व्युत्पन्न प्राप्त होते हैं ,लेकिन आयोडीन से अभिक्रिया करने पर एस्टर बनते हैं।
4: फिनोलिक यौगिक की फास्फोरस पेंटाहैलाइड से अभिक्रिया द्वारा: फिनोल को जब फास्फोरस पेंटाक्लोराइड से अभिक्रिया कराते हैं तो मुख्य उत्पाद ट्राई फ़ेनिल फास्फेट होता है और क्लोरो बेंजीन की मात्रा बहुत कम मात्रा में होती है। इसलिए यह विधि एरिलहैलाइड बनाने के लिए उपयुक्त नहीं है।
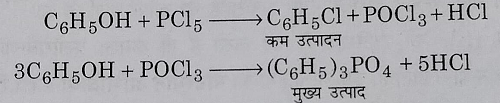
5: हैलोजनित अम्लों के विकारबॉक्सिलिकरण से: जब नाभिकीय प्रतिस्थापित एरोमेटिक अम्लों के सोडियम लवणों का सोडा लाइम के साथ आसवन किया जाता है तो उनका विकारबॉक्सिलिकरण हो जाता है और एरिलहैलाइड प्राप्त होते हैं।
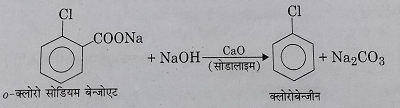
6: औद्योगिक निर्माण: बेंजीन वाष्प, वायु और हाइड्रोजन क्लोराइड के मिश्रण को तप्त CuCl2 या FeCl3 या Cu – Fe उत्प्रेरक के ऊपर 523 केल्विन ताप में उच्च दाब पर गुजरने पर क्लोरोबेंजीन प्राप्त होती है। इस प्रक्रम को राशिंग प्रक्रम कहते हैं।

हेलो एरिन के भौतिक और रासायनिक गुण
भौतिक गुण: हेलोएरिन के गुण निम्नलिखित हैं:
1: यह साधारण किया रंगहीन तेल जैसे द्रव ठोस पदार्थ होते हैं।
2: इनमें अभिलाक्षणिक गंध होती है।
3: यह कार्बनिक विलयाको जैसे एथेनॉल इधर एसीटोन आदि में विलय होते हैं।
4: इनका घनत्व जल से अधिक होता है।
रासायनिक गुण: हेलो एरिनो की महत्वपूर्ण रासायनिक अभिक्रियाएं निम्नलिखित है:
1: बेंजीन नाभिक के कारण अभिक्रियाएं:
A) एरिल हैलाइड की इलेक्ट्रो स्नेही प्रतिस्थापन अभिक्रियाएं: यह प्रतिस्थापन अभिक्रियाए बेंजीन नाभिक पर होती है इसलिए इन्हें नाभिक प्रतिस्थापन अभिक्रियाएं कहते हैं।
बेंजीन की o/p प्रतिस्थापन की प्रवृत्ति: क्लोरो बेंजीन में बेंजीन नाभिक के कार्बन परमाणु के साथ क्लोरीन परमाणु जुड़ा होता है जो ऋणात्मक प्रेरणिक प्रभाव (-I) व्यक्त करता है और यह बेंजीन नाभिक के कार्बन से इलेक्ट्रॉन अपनी ओर आकर्षित करने की प्रवृत्ति रखता है जिसके फलस्वरुप o/p प्रतिस्थापन का विरोध करता है परंतु धनात्मक इलेक्ट्रॉमेरिक तथा अनुनादी या मेसोमेरिक प्रभाव के कारण क्लोरीन परमाणु से इलेक्ट्रॉन बेंजीन नाभिक की ओर आकर्षित होते हैं।
यह दोनों प्रभाव साथ-साथ होते हैं जिसके फलस्वरुप इनके कारण o/p क्लोरीन परमाणु प्रतिस्थापन की प्रवृत्ति व्यक्त करता है।
बेंजीन, टालुईन और क्लोरोबेंजीन की इलेक्ट्रॉन स्नेही प्रतिस्थापी अभिक्रियाओ के लिए क्रियाशीलता का क्रम निम्न प्रकार होता है:
क्लोरोबेंजीन< बेंजीन< टालुईन
इनकी प्रमुख इलेक्ट्रो स्नेही प्रतिस्थापन अभिक्रियाएं निम्नलिखित है:
अ): नाइट्रिकरण: जब क्लोरो बेंजीन को 323 केल्विन ताप पर सांद्र नाइट्रिक और सल्फ्यूरिक अम्ल के मिश्रण के साथ नाइट्रिकृत किया जाता है तो o तथा p क्लोरो नाइट्रो बेंजीन बनती है, परंतु नाइट्रोजन की दर बेंजीन की अपेक्षा तीन गुना कम होती है।
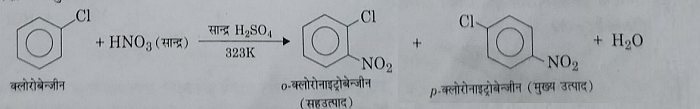
ब): हैलोजेनिकरण: यह हैलोजन वाहक जैसे Fe , FeCl3, FeBr3 आदि की उपस्थिति में हैलोजन के साथ अभिक्रिया करके हैलोजेनिकरण अभिक्रिया देते हैं।
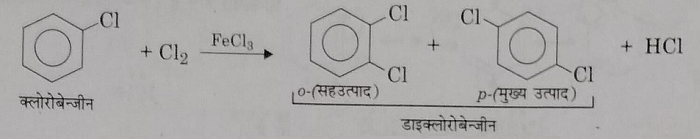
स): सल्फोनीकरण: इनको संधूम H2SO4 के साथ गर्म करने पर यह सल्फोनीकरण अभिक्रिया देते हैं।
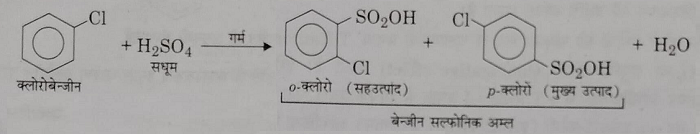
द): फ्रिडल क्राफ्टस अभिक्रिया: निर्जल AlCl3 या अन्य लुइस अम्लों की उपस्थिति में , एरिल क्लोराइड एल्कील हेलाइड व एसिल क्लोराइडो के साथ अभिक्रिया करके फ्रिडल क्राफ्ट्स अभिक्रिया देता है।
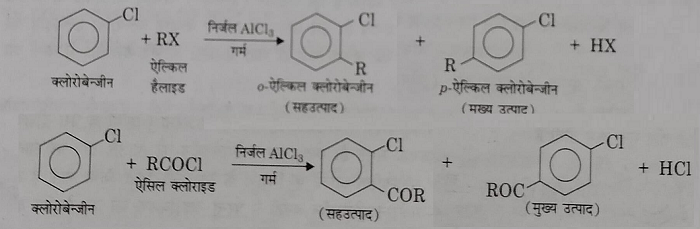
हेलोएरिन में C- X आबंध की प्रकृति और अनुनाद प्रभाव
2: हेलोएरिन में C- X आबंध की प्रकृति: यह आबंध हेलो एल्केन के C- X की अपेक्षा प्रबलतम होता है । इसे सरलता पूर्वक विदलीत नहीं किया जा सकता है। इसके मुख्य कारण निम्नलिखितहैं:
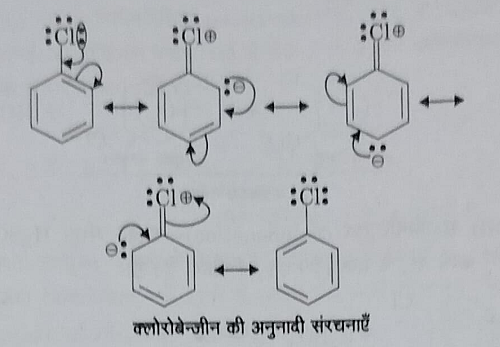
अ): अनुनाद प्रभाव: मनो हेलोएरिन इलेक्ट्रॉन युग्म के संयुग्मन के आधार पर निम्नलिखित पांच अनुनाद संरचनाएं प्राप्त होती हैं:
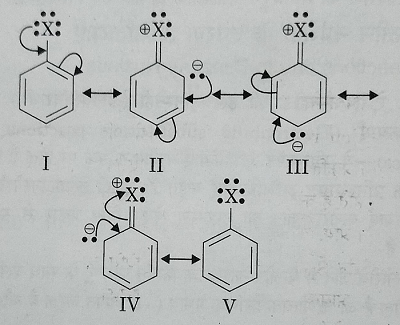
इन रचनाओं में II , III, व IV में X पर धनात्मक आवेश तथा बेंजीन वलय के C से आंशिक द्वि आबंध व्यक्त होता है। जिसके कारण C-X आबंध दूरी घट जाती है और C-X के प्रति आकर्षण अधिक होता है । इसलिए यह आसानी से विदलीत नहीं होता है।
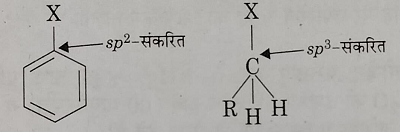
ब): C-X आबंध के कार्बन परमाणु की संकरण अवस्था: हेलो एरिन में C-X आबंध का C परमाणु SP2 संकरीत होता है जबकि हेलो एल्केन में C-X आबंध का C परमाणु SP3 संकरीत होता हैं।
हेलोएरिन में हैलोजन परमाणु के कारण अभिक्रियाएं
3: हैलोजन परमाणु के कारण अभिक्रियाएं:
अ): नाभिक स्नेही प्रतिस्थापन अभिक्रियाएं: हेलो एरिन SN1 व SN2 अभिक्रिया विधि व्यक्त नहीं करते हैं क्योंकि C-X आबंध की प्रबलता बहुत अधिक होती है जिसे तोड़ने हेतु अधिक ऊर्जा की आवश्यकता होती है।
परंतु फिर भी हेलो एरिन की नाभिक स्नेही प्रतिस्थापन अभिक्रियाएं विशेष परिस्थितियों में उच्च ताप व दाब पर संभव होती है जो निम्न प्रकार से होती हैं:
A): हैलोजन परमाणु का -OH समूह द्वारा प्रतिस्थापन: हेलो एरिन उच्च ताप पर जैसे 623 केल्विन व उच्च दाब जैसे 300 वायुमंडलीय दाब पर जलीय NaOH के 6 से 8 परसेंट विलयन के साथ अभिक्रिया करके फिनोल देते हैं।

फिनोल बनाने के इस प्रक्रम को डव प्रक्रम कहते हैं।
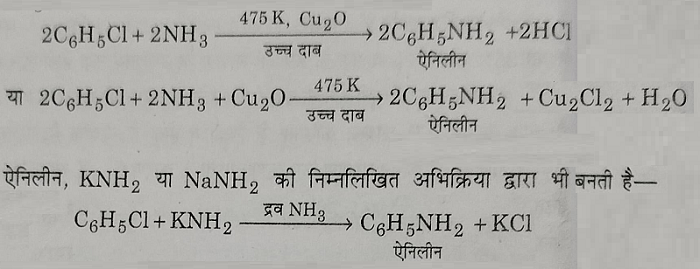
B): हैलोजन परमाणु का -NH2 समूह द्वारा प्रतिस्थापन: हेलोएरिन Cu2O की उपस्थिति में उच्च दाब जैसे 60 वायुमंडलीय दाब व 475 केल्विन ताप पर NH3 से अभिक्रिया करके एमीनो एरिन देते हैं।
C): हैलोजन परमाणु का साइनाइड समूह द्वारा प्रतिस्थापन: पिरीडिन या DMF की उपस्थिति में Cu2(CN)2 के साथ 475 केल्विन ताप व 50 वायुमंडलीय दाब पर एरिल हेलाइड अभिक्रिया द्वारा एरिल साइनाइड बनाते है।

इस chapter के सभी भाग
हेलोएरिन की अन्य अभिक्रियाएं जैसे उलमान अभिक्रिया और उपयोग
4: अन्य अभिक्रियाएं:
अ): ग्रिगनार्ड अभिकर्मक: एरिल हैलाइड शुष्क ईथर या शुष्क टेट्रा हाइड्रो फ्यूरान की उपस्थिति में मैग्नीशियम के साथ अभिक्रिया करके एरिल मैग्नीशियम हेलाइड बनाते हैं। जिसे ग्रिगनार्ड अभिकर्मक के नाम से जाना जाता है।

ब): वुरट्ज फिटिंग अभिक्रिया: जब किसी एरिल हेलाइड को किसी एल्कील हेलाइड के साथ, धात्विक सोडियम की उपस्थिति में शुष्क इधर विलन में अभिक्रिया कराते हैं तो बेंजीन का एल्किल व्युत्पन्न प्राप्त होता है। यह अभिक्रिया वुरट्ज फिटिंग अभिक्रिया कहलाती है।
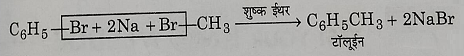
एरिल हैलाइड इन परिस्थितियों में स्वयं अपने आप से भी अभिक्रिया करके द्वि नाभिकीय हाइड्रोकार्बन बना लेता है जिसे फिटिंग अभिक्रिया के नाम से जाना जाता है।
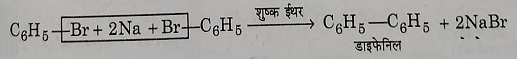
स): उलमान अभिक्रिया: जब आयोड़ो या ब्रोमो बेंजीन को तांबे या सिल्वर चूर्ण के साथ, एक बंद नली में गर्म किया जाता है, तो एरोमेटिक नाभिक परस्पर युगमित होकर एक डाई एरिल व्युत्पन्न बनाते हैं। यह अभिक्रिया उलमान अभिक्रिया कहलाती है।
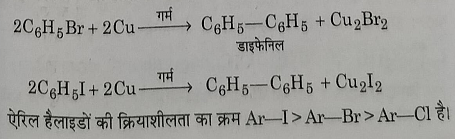
द): अपचयन: Ni- Al मिश्रधातु एवं सोडियम हाइड्रोक्साइड की अभिक्रिया द्वारा प्राप्त नवजात हाइड्रोजन हैलोजन का अपचयन करके बेंजीन देती है।

य): क्लोरल से अभिक्रिया: सांद्र सल्फ्यूरिक अम्ल की उपस्थिति में क्लोरोबेंजेने को क्लोरल के साथ गर्म करने पर संघनन अभिक्रिया के फल स्वरुप में डीडीटी प्राप्त होता है जो की एक शक्तिशाली कीटनाशक पदार्थ है।
हेलो एरिन के उपयोग: हेलो एरिन निम्नलिखित उपयोग हैं:
1: विभिन्न औषधीय के निर्माण में
2: विभिन्न कार्बनिक यौगिकों के निर्माण में
3: विभिन्न कार्बनिक यौगिक जैसे DDT, एनिलिन फिनोल डाई फिनोल आदि के निर्माण में।
क्लोरो बेंजीन और इसकी निर्माण विधियाँ
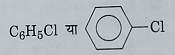
क्लोरो बेंजीन:
सूत्र:
निर्माण विधियां: क्लोरोबेंजीन का निर्माण निम्न विधियों द्वारा किया जा सकता है:
1: प्रयोगशाला विधि: प्रयोगशाला में क्लोरो बेंजीन का निर्माण डाईएजोनियम क्लोराइड को क्यूप्रस क्लोराइड (Cu2Cl2) का HCl में बने विलियन को लगभग 333 केल्विन ताप पर गर्म करके किया जाता है जिसे सेंडमायर अभिक्रिया भी कहते हैं।

विधि :
प्रथम पद: एक फ्लास्क में पहले लगभग 20 ग्राम एनिलीन को तनु HCl में घोलकर 273 से 287K तक ठंडा कर लेते हैं। इसके बाद इसमें NaNO2 का ठंडा जलीय विलियन मिलाते हैं जिसके उपरांत नाइट्रस अमल बनता है जो एनिलिन से HCl की उपस्थिति में अभिक्रिया करके बेंजीन डाईएजोनियम क्लोराइड का विलियन बनाते हैं। इस विलयन को एक पृथककारी फ़नल में भर लेते हैं।
द्वितीय पद: एक आसवन फ्लास्क में लगभग 10 ग्राम क्यूप्रस क्लोराइड को 100 ml सांद्र हाइड्रोक्लोरिक अम्ल में घोलकर ले लेते हैं। जिसमें एक पृथक्कारी फ़नल तथा वायु संघनित्र लगा होता है।
तृतीय पद: फ्लास्क को को जल- ऊष्मक में 333 K पर गर्म करके पृथक्कारी फ़नल से बेंजीन डाईएजोनियम क्लोराइड विलियन धीरे-धीरे डाला जाता है। अब इसको 30 मिनट तक जल- ऊष्मक पर गर्म करते हैं। अभिक्रिया पूर्ण होने पर बना हुआ क्लोरोबेंजीन तेल जैसे द्रव के रूप में मिश्रण की ऊपरी सतह पर तैरने लगता है। जिसको जल से धोकर निर्जल कैल्शियम क्लोराइड से सुखाकर 405 केल्विन पर पुन: आसवन करने से शुद्ध क्लोरोबेंजीन प्राप्त हो जाता है।
2: बेंजीन से: हैलोजन वाहक की उपस्थिति में गर्म बेंजीन में शुष्क क्लोरीन गैस प्रवाहित करने से क्लोरोबेंजीन प्राप्त होती है।
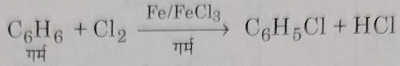
3: फिनोल से: फिनोल पर फास्फोरस पेंटाक्लोराइड की अभिक्रिया से क्लोरोबेंजीन बनता है इस अभिक्रिया में मुख्य उत्पाद क्लोरो बेंजीन नहीं होता है।
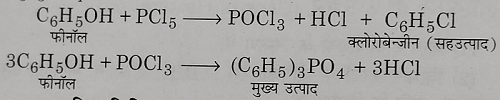
4: व्यापारिक विधि: औद्योगिक निर्माण के लिए बेंजीन वाष्प, वायु और हाइड्रोजन क्लोराइड गैस के मिश्रण को तप्त उत्प्रेरक के ऊपर 530 केल्विन ताप व उच्च दाब पर प्रवाहित करने से क्लोरोबेंजीन बनती है ।

क्लोरो बेंजीन भौतिक व रासायनिक गुण और उपयोग
भौतिक गुण: क्लोरो बेंजीन के भौतिक गुण निम्नलिखित है:
1: यह रंगहीन सुगंधित व भारी द्रव होता है।
2: इसका क्वथनांक 405 केल्विन होता है।
3: यह जल में अविलेय परंतु अल्कोहल तथा इधर में पूर्ण रूप से विलय होता है।
रासायनिक गुण: क्लोरोबेंजीन तीन प्रकार की रासायनिक अभिक्रिया देता है। जिनको हेलो एरिन में मुख्यतः क्लोरोबेंजीन के रासायनिक गुण के रूप में देखा जाता है।
क्लोरोबेंजीन के उपयोग: इसके प्रयोग निम्नलिखित हैं:
1: इसकी सहायता से विभिन्न एरोमेटिक योगीको का निर्माण किया जाता है ।
2: इसकी सहायता से कीटनाशक पदार्थ डीडीटी का निर्माण किया जाता है।
3: फफूंदनासी, डाई एजोरंजक आदि का निर्माण इसी की सहायता से किया जाता है।













