Class 12 Chemistry Chapter 4 d और f ब्लॉक के तत्त्व Part 4 d और f ब्लॉक के तत्त्व का ही एक अहम् भाग है | अगर आप इस इकाई अथवा पाठ को अच्छे से अध्ययन करना चाहते है तो हम आपसे यही अनुरोध करते है कि आप इस बहुत बड़ी इकाई को छोटे छोटे part में पढ़े | यही वजह है कि हम आपको यहाँ पर part वाइज नोट्स Provide कर रहे है | इस part में जो भी महत्वपूर्ण हैडिंग है उन्हें जरूर याद करे | क्यूंकि ये ही आपको अच्छे मार्क्स प्राप्त करने में मदद करेंगी |
Table of Contents
ToggleIf you need online tutor or help for any questions like mathematics, physics, chemistry numerical or theory then you can contact me on WhatsApp on +918755084148 or click here. Our team help you all time with cheap and best price. If need it on video our team provide you short video for your problem. So keep in touch of our team specialists.
Class 12 Chemistry Chapter 4 d और f ब्लॉक के तत्त्व Part 4
Class 12 Chemistry Chapter 4 d और f ब्लॉक के तत्त्व Part 4 में हम बोर्ड में पूछे गये कम से कम 3 से 5 मार्क्स का अध्ययन करेंगे | अत: आप इन्हें ध्यान से पढ़े | अगर आप कुछ समस्या महसूस करते है तो आप हमे सम्पर्क कर सकते हो और आप Ask Question पर क्लिक करके प्रश्न भी पूछ सतके हो | हम आपसे ये गुजारिश करते है कि आप इन महत्वपूर्ण हैडिंग को अवस्य याद करेंगे | क्यूंकि ये वो सभी हैडिंग है जो पिछले बहुत सालो के पेपर में रिपीट हुई है | अगर आप इन्हें याद करके एग्जाम में बैठते है तो आप 90 % से अधिक अंक हासिल कर सकते है |
Class 12 Chemistry Chapter 4 d और f ब्लॉक के तत्त्व Part 4 में महत्वपूर्ण Headings निम्नलिखित है | इन्हें अच्छे से याद करे | ये आपको अच्छे अंक दिलाने में मदद करेगी:
- संक्रमण तत्वों के कुछ महत्वपूर्ण योगिक
- पोटैशियम डाईक्रोमेट और इसकी निर्माणविधि
- पोटैशियम डाईक्रोमेट के भौतिक और रासायन गुण
- क्रोमेट एवं डाईक्रोमेट आयन की संरचनाएं
- क्रोमिल क्लोराइड परीक्षण और पोटैशियम डाईक्रोमेट के उपयोग
- पोटैशियम परमैग्नेट और इसकी निर्माणविधि
- पोटैशियम परमैग्नेट के भौतिक और रासायन गुण
- मैग्नेट तथा परमैग्नेट आयनो की संरचनाएं और उपयोग

संक्रमण तत्वों के कुछ महत्वपूर्ण योगिक
संक्रमण तत्वों के कुछ महत्वपूर्ण योगिक: संक्रमण धातुएं ऑक्सीजन और अन्य तत्वों के साथ अभिक्रिया करके बहुत सारे योगिक बनाते है । इस अध्याय में हम निम्नलिखित दो महत्वपूर्ण योगिक के बारे में पढ़ेंगे :
- पोटैशियम डाईक्रोमेट
- पोटेशियम परमैंगनेट
पोटैशियम डाईक्रोमेट और इसकी निर्माणविधि
पोटैशियम डाईक्रोमेट:- यह एक ऐसा योगिक है जो फेरस आयोडाइड और सल्फाइड आदि के आयनो की गणना करने में सहायता प्रदान करता है और कार्बनिक रसायन में ऑक्सीकारक के रूप में प्रयोग किया जाता है।
निर्माण: पोटैशियम डाई क्रोमेट का निर्माण समानता क्रोमाइट अयस्क से किया जाता है। इस प्रक्रम में निम्नलिखित पद हैं:
1: क्रोमाइट अयस्क का सोडियम क्रोमेट में परिवर्तन: क्रोमाइट अयस्क को सोडा ऐश अथवा सोडियम कार्बोनेट तथा बिना बुझे चूने के साथ मिलाया जाता है। फिर इस मिश्रण को एक परावर्तनी भट्टी में वायु के अधिक्य में भर्जित किया जाता है । इस भर्जन की प्रक्रिया में सोडियम क्रोमेट का पीला द्रव्यमान प्राप्त होता है।

2: सोडियम क्रोमेट का सोडियम डाईक्रोमेट में परिवर्तन: प्राप्त सोडियम क्रोमेट विलयन की सांद्र सल्फ्यूरिक अम्ल के साथ अभिक्रिया कराई जाती है जिसके उपरांत सोडियम डाई क्रोमेट प्राप्त होता है।
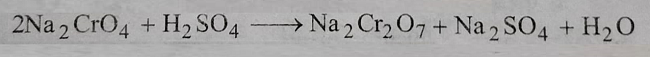
प्राप्त विलन सांद्र होता है और इसमें से घुलित सोडियम सल्फेट क्रिस्टलीकरण हो जाता है। इसको गर्म अवस्था में ही फिल्टर कर लेते हैं जिसको ठंडा करने पर कुछ समय पश्चात सोडियम डाई क्रोमेट क्रिस्टल प्राप्त होते हैं।
3: सोडियम डाईक्रोमेट से पोटैशियम डाईक्रोमेट का निर्माण: क्यूंकि सोडियम डाईक्रोमेट ,पोटैशियम डाईक्रोमेट की अपेक्षा अधिक घुलनशील तथा कम अस्थाई होता है। इसलिए पोटैशियम डाईक्रोमेट को पोटेशियम क्लोराइड तथा सोडियम डाईक्रोमेट की अभिक्रिया द्वारा प्राप्त किया जा सकता है। इस अभिक्रिया के पश्चात पोटैशियम डाईक्रोमेट के नारंगी क्रिस्टल प्राप्त होते हैं।

पोटैशियम डाईक्रोमेट के भौतिक और रासायन गुण
गुण :
1: भौतिक अवस्था : पोटैशियम डाईक्रोमेट नारंगी लाल रंग का क्रिस्टल होता है। इसका गलनांक 669 केल्विन होता है। यह गर्म जल में विलय होता है ।
2: उसका का प्रभाव : अधिक गर्म करने पर यह अपघटित होकर पोटैशियम क्रोमेट बनाता है और ऑक्सीजन गैस निकलती है।
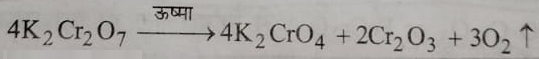
3: अम्लों की अभिक्रिया : ठंडे तथा सांद्र सल्फ्यूरिक अम्ल के साथ यह अभिक्रिया करके क्रोमिक एनहाइड्राइड के लाल क्रिस्टल बनाता है।

4: क्षारों की अभिक्रिया: यह क्षारो के साथ अभिक्रिया करके पीले रंग के क्रोमेट बनाता हैं।
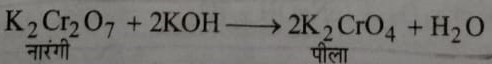
5: ऑक्सीकारक गुण: अम्लीय माध्यम में यह प्रबल ऑक्सीकारक की भांति कार्य करता है जब इसकी अभिक्रिया तनु सल्फ्यूरिक अम्ल से कराई जाती है तो यह निम्न समीकरण के अनुसार नवजात ऑक्सीजन का निर्माण करता है।
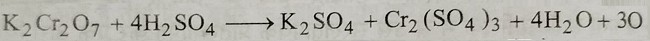
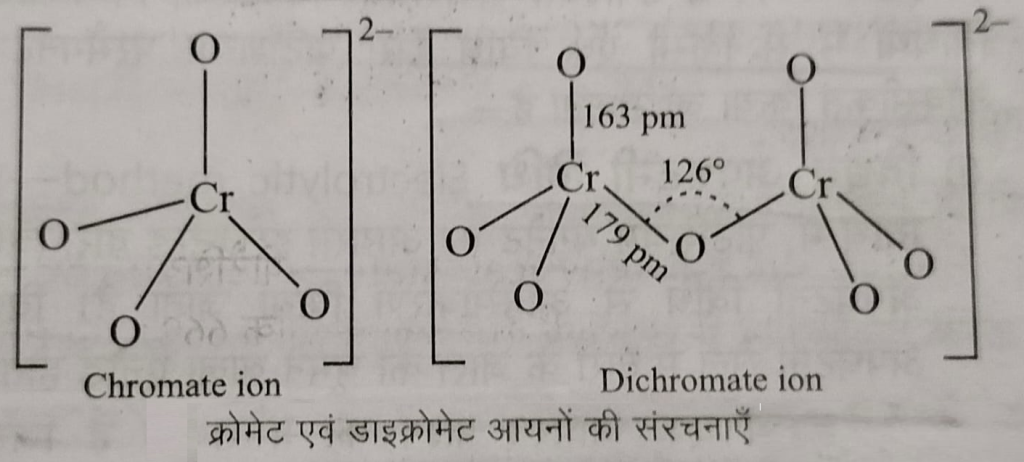
क्रोमेट एवं डाईक्रोमेट आयन की संरचनाएं
क्रोमेट एवं डाईक्रोमेट आयन की संरचनाएं: क्रोमेट आयन चतुष्फलकिय होता है जिसमें चार ऑक्सीजन परमाणु केंद्रीय क्रोमियम परमाणु के चारों ओर चतुष्फलकिय रूप में व्यवस्थित होते हैं, जबकि डाईक्रोमेट आयन में दो चतुष्फलकियो के शीर्ष आपस में साझेदारी किए रहते हैं। जिसमें Cr-O-Cr आबंध को का मन 126 डिग्री होता है।
इस chapter के सभी भाग
क्रोमिल क्लोराइड परीक्षण और पोटैशियम डाईक्रोमेट के उपयोग
क्रोमिल क्लोराइड परीक्षण : जब पोटैशियम डाईक्रोमेट को सांद्र सल्फ्यूरिक अम्ल तथा किसी विलय धातु क्लोराइड के साथ गर्म किया जाता है तो क्रोमिल क्लोराइड की नारंगी लाल वाष्प प्राप्त होती है।
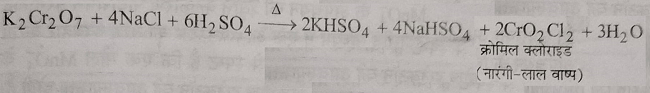
जब क्रोमिल क्लोराइड की वाष्प को जल में प्रवाहित करते हैं तो क्रोमिक अम्ल का पीला विलियन प्राप्त होता है।
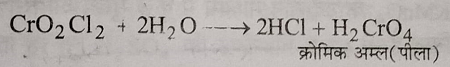
इस विलयन की जब लेड एसीटेट तथा एसिटिक अम्ल के साथ अभिक्रिया कराई जाती है तो लेड क्रोमेट का पीला अवक्षेप प्राप्त होता है।
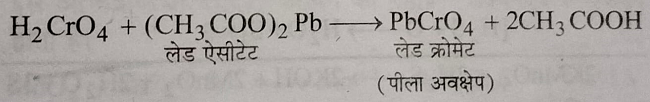
यह परीक्षण क्रोमिल क्लोराइड परीक्षण कहलाता है। इसका उपयोग क्लोराइड आयन के गुणात्मक विशेषण में किया जाता है।
उपयोग : इसके प्रयोग निम्नलिखित है:
- आयतनी विश्लेषण में फेरस आयोडाइड तथा सल्फाइड आदि आयनो की गणना करने में
- कार्बनिक रसायन में ऑक्सीकारक के रूप में
- चमड़ा उद्योग में
- कैलिको प्रिंटिंग तथा रंजन प्रक्रिया में
- फोटोग्राफी में फिल्म को कठोर बनाने में।
पोटैशियम परमैग्नेट और इसकी निर्माणविधि
पोटैशियम परमैग्नेट: पोटैशियम परमैग्नेट एक ऐसा योगिक है जो सामान्यतः प्रयोगशाला में ऑक्सीकारक के रूप में उपयोग किया जाता है। इसका प्रयोग कीटाणु नाशक के रूप में भी कुओं के पानी को कीटाणु मुक्त करने के लिए किया जाता है आई इसके बारे में अच्छे से अध्ययन करते हैं।
निर्माण विधि: पोटैशियम परमैग्नेट का निर्माण पाइरोलुसाइट अयस्क से बड़े पैमाने पर किया जाता है। इस प्रक्रम में निम्नलिखित पद होते हैं:
1: पाइरोलुसाइट का पोटेशियम मैग्नेट में परिवर्तन : पाइरोलुसाइट अयस्क को पोटेशियम हाइड्रोक्साइड या पोटेशियम कार्बोनेट के साथ वायु अथवा किसी ऑक्सीकारक पदार्थ की उपस्थिति में गलाया जाता है जिससे हर रंग का पोटेशियम मैग्नेट प्राप्त होता है ।
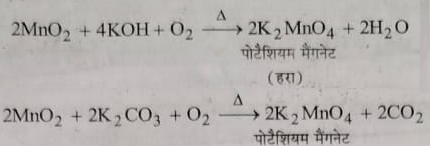
2: पोटेशियम मैग्नेट का पोटैशियम परमैग्नेट में ऑक्सीकरण: प्रथम पद द्वारा प्राप्त गलित पदार्थ का जल द्वारा निष्कर्षण किया जाता है जिससे हर रंग का विलयन प्राप्त होता है। इस विलियन में उपस्थित पोटेशियम मैग्नेट को निम्नलिखित विधियो में से किसी एक विधि द्वारा पोटेशियम परमैग्नेट में ऑक्सीकरण किया जाता है:
अ) विद्युत अपघटनी विधि : इस विधि में पोटेशियम मैग्नेट का आयरन इलेक्ट्रोड द्वारा विद्युत अपघटनी विधि से ऑक्सीकरण किया जाता है । इसमें विद्युत अपघटनी सेल होता है जिसमें तारों के जाल का घूमने वाला एनोड होता है तथा एक आयरन पाइप का प्रवेश द्वार होता है जिससे पोटेशियम मैग्नेट का विलियन सेल के अंदर प्रविष्ट कराया जाता है। आयरन पाइप कैथोड का कार्य करता है। विद्युत धारा प्रवाहित करने पर निम्नलिखित अभिक्रियाएं संपन्न होती हैं :
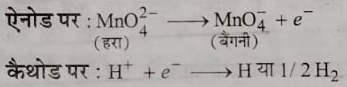
उपरोक्त विधि से प्राप्त बैंगनी विलयन को नियंत्रित परिस्थितियों में वाष्पित करके पोटेशियम परमैग्नेट के क्रिस्टल प्राप्त किए जाते हैं ।
ब) रासायनिक विधि : इस विधि में पोटेशियम मैग्नेट की क्रिया कार्बन डाइऑक्साइड अथवा क्लोरीन अथवा ओजोन के साथ कराई जाती है जिससे पोटेशियम मैग्नेट का पोटेशियम परमैग्नेट में ऑक्सीकरण हो जाता है :
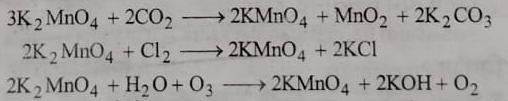
3: प्रयोगशाला विधि : प्रयोगशाला में मैंगनीज (||) लवण के परऑक्सोडाईसल्फेट द्वारा ऑक्सीकरण करके पोटेशियम परमैग्नेट प्राप्त किया जाता है:

पोटैशियम परमैग्नेट के भौतिक और रासायन गुण
गुण : इसके निम्नलिखित गुण हैं :
1: भौतिक गुण : पोटेशियम परमैग्नेट एक क्रिस्टलीय ठोस है । यह चमक वाले गहरे बैंगनी रंग के क्रिस्टल बनाता है। इसका गलनांक 513 केल्विन होता है।
2: विलेयता : यह जल में साधारण ताप पर काम विलय होता है।
3: ताप का प्रभाव : यह साधारण ताप पर स्थाई है परंतु 513 केल्विन ताप से ऊपर गर्म करने पर यह अप घटित होकर ऑक्सीजन देता है।

4 : हाइड्रोजन से अभिक्रिया : यह हाइड्रोजन से अभिक्रिया करके पोटेशियम हाइड्रोक्साइड मैगनस ऑक्साइड तथा बाप बनाता है ।
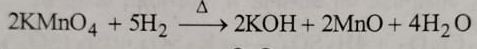
5: ऑक्सीकारक गुण: पोटेशियम परमैग्नेट उदासीन अम्लीय तथा अक्सर यह माध्यम में एक प्रबल ऑक्सीकारक होता है ।
मैग्नेट तथा परमैग्नेट आयनो की संरचनाएं और उपयोग
मैग्नेट तथा परमैग्नेट आयनो की संरचनाएं : दोनों ही आयन चतुष्क फ्लकीय होते हैं। हरे रंग का मैग्नेट आयन एक आयुग्मित इलेक्ट्रॉन की उपस्थिति के कारण अनुचुंबकीय होता है जबकि बैगनी रंग का परमैग्नेट आयन आयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण प्रतिचुंबकीय प्रकृति का होता है।
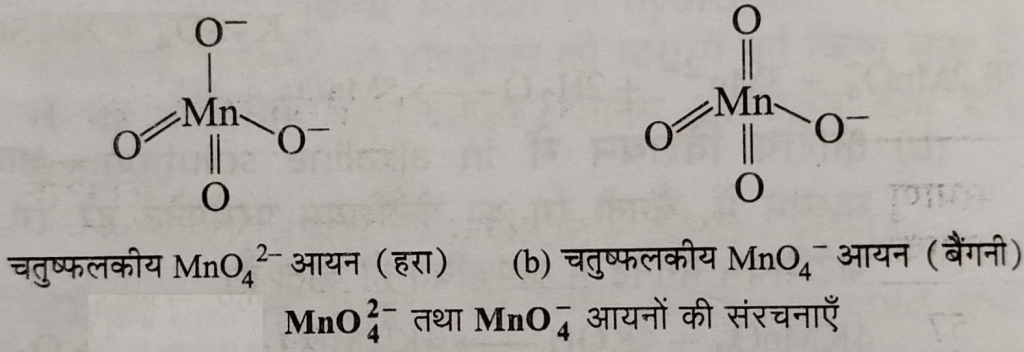
उपयोग : इसके प्रयोग निम्नलिखित हैं :
- इसका उपयोग प्रयोगशाला में ऑक्सीकारक के रूप में किया जाता है।
- इसका उपयोग आया इतनी विश्लेषण में फेरस लवण तथा ऑक्सिलेट आदि के आकलन में किया जाता है।
- इसका प्रयोग कीटाणु नाशक के रूप में किया जाता है जैसे कुओं के पानी को कीटाणु मुक्त करने के लिए।
- इसके क्षारीय विलयन को सामान्यतः प्रयोग कार्बनिक रसायन में उपयोग में लाया जाता है। इसे बायर अभिकर्मक भी कहते हैं।








