Class 12 Chemistry Chapter 6 हैलोएल्केन तथा हैलोऐरीन Part 3 हैलोएल्केन तथा हैलोऐरीन अथवा Heloelken tatha heloerin का ही एक अहम् भाग है | अगर आप इस इकाई अथवा पाठ को अच्छे से अध्ययन करना चाहते है तो हम आपसे यही अनुरोध करते है कि आप इस बहुत बड़ी इकाई को छोटे छोटे part में पढ़े | यही वजह है कि हम आपको यहाँ पर part वाइज नोट्स Provide कर रहे है | इस part में जो भी महत्वपूर्ण हैडिंग है उन्हें जरूर याद करे | क्यूंकि ये ही आपको अच्छे मार्क्स प्राप्त करने में मदद करेंगी |
Table of Contents
ToggleIf you need online tutor or help for any questions like mathematics, physics, chemistry numerical or theory then you can contact me on WhatsApp on +918755084148 or click here. Our team help you all time with cheap and best price. If need it on video our team provide you short video for your problem. So keep in touch of our team specialists.
Class 12 Chemistry Chapter 6 हैलोएल्केन तथा हैलोऐरीन Part 3
Class 12 Chemistry Chapter 6 हैलोएल्केन तथा हैलोऐरीन Part 3 में हम बोर्ड में पूछे गये कम से कम 3 से 5 मार्क्स का अध्ययन करेंगे | अत: आप इन्हें ध्यान से पढ़े | अगर आप कुछ समस्या महसूस करते है तो आप हमे सम्पर्क कर सकते हो और आप Ask Question पर क्लिक करके प्रश्न भी पूछ सतके हो | हम आपसे ये गुजारिश करते है कि आप इन महत्वपूर्ण हैडिंग को अवस्य याद करेंगे | क्यूंकि ये वो सभी हैडिंग है जो पिछले बहुत सालो के पेपर में रिपीट हुई है | अगर आप इन्हें याद करके एग्जाम में बैठते है तो आप 90 % से अधिक अंक हासिल कर सकते है |
Class 12 Chemistry Chapter 6 हैलोएल्केन तथा हैलोऐरीन Part 3 में महत्वपूर्ण Headings निम्नलिखित है | इन्हें अच्छे से याद करे | ये आपको अच्छे अंक दिलाने में मदद करेगी:
- एथिल ब्रोमाइड और बनाने की विधियां
- एथिल ब्रोमाइड के भौतिक गुण
- एथिल ब्रोमाइड के रासायनिक गुण
- एथिल ब्रोमाइड की प्रमुख अभिक्रियाएं और उपयोग
- डाईहेलोएल्केन जैसे डाईक्लोरोमेथेन , जैम- डाईहैलाइड और विस- डाईहैलाइड
- डाईक्लोरोमेथेन और इसकी निर्माण विधियां
- डाईक्लोरोमेथेन के भौतिक और रासायनिक गुण
- डाईक्लोरोमेथेन के उपयोग और हानिकारक प्रभाव
- जेम – डाईहैलाइड और इसकी बनाने की विधियां
- जेम – डाईहैलाइड के भौतिक और रासायनिक गुण
- जेम – डाईहैलाइड के उपयोग
- विस – डाइहैलाइड और इसकी बनाने की विधियां
- विस – डाइहैलाइड के भौतिक और रासायनिक गुण
- विस – डाइहैलाइड के उपयोग
- ट्राई हेलो एल्केन और हेलोफॉर्म
- क्लोरोफॉर्म और इसकी निर्माण विधियां
- क्लोरोफॉर्म के भौतिक और रासायनिक गुण
- कार्बीलएमीन अभिक्रिया और राइमर टीमैन अभिक्रिया
- क्लोरोफॉर्म के उपयोग और शुद्ध क्लोरोफॉर्म परीक्षण
- आयोड़ोंफार्म और इसकी निर्माण विधियां
- आयोड़ोंफार्म के भौतिक और रासायनिक गुण
- आयोड़ोंफार्म के उपयोग

एथिल ब्रोमाइड और बनाने की विधियां
एथिल ब्रोमाइड:
बनाने की विधियां : एथिल ब्रोमाइड को अनेक प्रकार से बनाया जा सकता है । जिनमें से कुछ निम्न है:
1: एथिलीन से : जब एथिलीन को हाइड्रोजन ब्रोमाइड के साथ मिलाया जाता है तो एथिल ब्रोमाइड बनती है। यह विधि एथिल ब्रोमाइड के औद्योगिक उत्पादन के लिए प्रयुक्त की होती है।
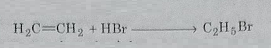
2: प्रयोगशाला विधियां : इसे प्रयोगशाला में निम्न दो विधियों द्वारा बनाया जाता है:
अ) एथिल एल्कोहल पोटैशियम ब्रोमाइड और सांद्र सल्फ्यूरिक अम्ल के मिश्रण के आसवन से एथिल ब्रोमाइड प्राप्त होता है यह अभिक्रिया दो पदों में संपन्न होती है।
प्रथम पद : KBr, सांद्र सल्फ्यूरिक अम्ल से अभिक्रिया करके हाइड्रोजन ब्रोमाइड मुक्त करता है।
द्वितीय पद : इस पद में हाइड्रोजन ब्रोमाइड और एथिल एल्कोहल अभिक्रिया करके एथिल ब्रोमाइड बनाते हैं ।

ब) इस विधि में एथिल ब्रोमाइड , एथिल एल्कोहल पर ब्रोमीन तथा लाल फास्फोरस की अभिक्रिया द्वारा प्राप्त होता है। इसमें सर्वप्रथम लाल फास्फोरस तथा ब्रोमीन परस्पर अभिक्रिया करके फास्फोरस ट्राई या पेंटा ब्रोमाइड बनाते हैं । अब यह फास्फोरस ब्रोमाइड एल्कोहल से अभिक्रिया करके एथिल ब्रोमाइड बनाते हैं ।
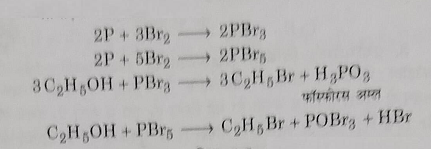
एथिल ब्रोमाइड के भौतिक गुण
एथिल ब्रोमाइड के गुण:
अ) भौतिक गुण :
- यह एक रंगहीन तथा मधुर गंध वाला सुगंधित भारी द्रव होता है।
- यह जल में अविलेय परंतु कार्बनिक विलायकों में विलय होता है।
- इसका क्वथनांक 311 केल्विन होता है और वायु में हरी नीली ज्वाला के साथ जलता है।
- यह ठंडे व सांद्र सल्फ्यूरिक अम्ल में अविलेय होता है।
ब) रासायनिक गुण : एथिल ब्रोमाइड में दो भाग होते हैं एक एथिल मूलक और दूसरा ब्रोमीन परमाणु:

क्योंकि ब्रोमीन परमाणु अत्यधिक क्रियाशील होता है इसलिए यह अन्य परमाणुओं या मुलकों के द्वारा प्रतिस्थापित किया जा सकता है । अतः इसकी सहायता से विभिन्न कार्बनिक यौगिक का संश्लेषण किया जा सकता है।
एथिल ब्रोमाइड की प्रमुख अभिक्रियाएं:
1: अपचयन: जब एथिल ब्रोमाइड का नवजात हाइड्रोजन द्वारा अपचयन करते हैं तो शुद्ध एथेन प्राप्त होती है।
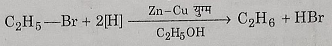
2: वुर्टज अभिक्रिया: जब एथिल ब्रोमाइड की अभिक्रिया सोडियम के साथ शुष्क ईथर की उपस्थिति में कराई जाती है तो न-ब्यूटेन प्राप्त होता है यह अभिक्रिया वुर्टज अभिक्रिया के नाम से जानी जाती है।
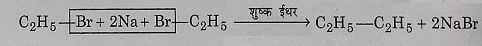
3: फ्रैंकलैंड अभिक्रिया: एथिल ब्रोमाइड को शुष्क ईथर की उपस्थिति में जिंक के साथ गर्म करने पर संघनन करने से न-ब्यूटेन बनता है।

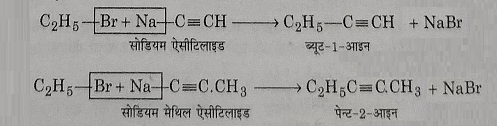
4: सोडियम एल्किनाइडो से अभिक्रिया: एथिल ब्रोमाइड, सोडियम एल्किनाइडो से अभिक्रिया करके उच्च एल्काइन बनाते हैं।
5: धातुओं के साथ अभिक्रिया: शुष्क ईथर में एल्किल हैलाइड को मैग्नीशियम धातु के चूर्ण के साथ गर्म करने पर एल्किल मैग्नीशियम हैलाइड बनता है जिसे ग्रिगनार्ड अभिकर्मक के नाम से जानते हैं।

6: क्षारीय जल अपघटन: कास्टिक सोडा या कास्टिक पोटाश के जलीय विलयन के साथ अभिक्रिया करने पर एथिल ब्रोमाइड का जल अपघटन हो जाता है जिसके फल स्वरुप एथिल एल्कोहल प्राप्त होता है।
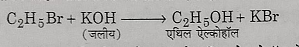
7: एल्कोहलिक कास्टिक पोटाश से अभिक्रिया: जब एथिल ब्रोमाइड को पोटैशियम हाइड्रोक्साइड के एल्कोहलिक विलयन के साथ गर्म किया जाता है तो विहाइड्रोब्रोमीनीकरण के कारण एथिलीन प्राप्त होती है।
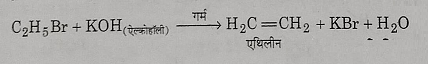
8: पोटेशियम आयोडाइड या सोडियम आयोडाइड के साथ अभिक्रिया: एसीटोन या मैथिल एल्कोहल की उपस्थिति में एथिल ब्रोमाइड को पोटैशियम आयोडाइड के साथ गर्म करने पर एथिल आयोडाइड बनता है और यह अभिक्रिया कोनांट फ़िंकल स्टीन अभिक्रिया का एक उदाहरण है।

9: एल्कोहलिक पोटेशियम साइनाइड से अभिक्रिया: जब एथिल ब्रोमाइड को एल्कोहलिक पोटेशियम साइनाइड विलयन के साथ गर्म करते हैं तो अधिक मात्रा में एथिल साइनाइड बनता है।

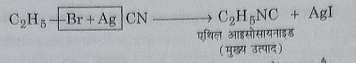
10: सिल्वर साइनाइड से अभिक्रिया: जब एथिल ब्रोमाइड जलीय एल्कोहलिक सिल्वर साइनाइड से अभिक्रिया करता है तो एथिल आइसोसायनाइड बनता है।
एथिल ब्रोमाइड की प्रमुख अभिक्रियाएं और उपयोग
11: सोडियम एल्कॉक्साइड से अभिक्रिया: जब एथिल ब्रोमाइड सोडियम एल्कॉक्साइड के साथ गर्म किया जाता है तो ईथर प्राप्त होते हैं।

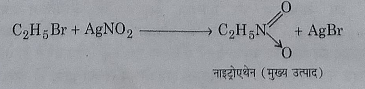
12: एल्कोहलिक अमोनिया से अभिक्रिया: जब एथिल ब्रोमाइड को अमोनिया के साथ एक बंद नली में उच्च दाब पर अभिकृत किया जाता है तो ब्रोमीन परमाणु अमीनो मूलक के द्वारा प्रतिस्थापित होकर एथिल एमीन बनाता है।

एथिल अमीन पुन: एथिल ब्रोमाइड के आधिक्य से अभिक्रिया करके क्रमशः डाईएथिल एमीन, ट्राईएथिल एमीन और टेट्रा एथिल अमोनियम ब्रोमाइड बनाती है।
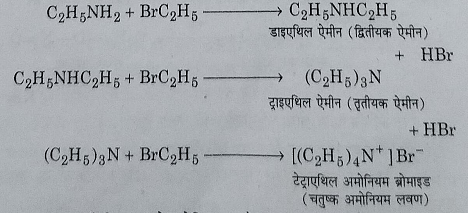
इस अभिक्रिया को एल्किल हेलाइड का अमोनिया अपघटन भी कहते हैं और यह हाॅफमैन की अमीन बनाने की विधि है।
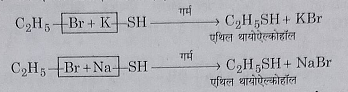
13: पोटेशियम या सोडियम हाइड्रोजन सल्फाइड से अभिक्रिया: जब एथिल ब्रोमाइड को जलीय एल्कोहलिक पोटेशियम या सोडियम हाइड्रोजन सल्फाइड के साथ गर्म करते है तो ब्रोमीन परमाणु का प्रतिस्थापन होने के उपरांत एथिल थायोएल्कोहल प्राप्त होते हैं।
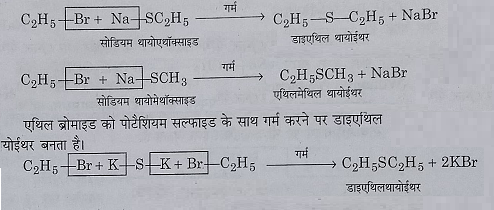
14: सोडियम या पोटेशियम मार्केप्टाइड या सल्फाइड के साथ अभिक्रिया: जब एथिल ब्रोमाइड को मार्केप्टाइड के साथ एल्कोहलिक विलियन में गर्म करते हैं तो थायोइधर बनते हैं।
15: सिल्वर एसीटेट के साथ अभिक्रिया: एथिल ब्रोमाइड को एल्कोहलिक विलियन में वसा अम्लों के सिल्वर लवण के साथ गर्म करने पर एस्टर प्राप्त होते हैं।

16: पोटेशियम नाइट्राइट से अभिक्रिया: पोटेशियम नाइट्राइट के साथ गर्म करने पर ब्रोमीन परमाणु नाइट्राइट मूलक द्वारा प्रतिस्थापित होकर एथिल नाइट्राइट बनाता है। इस अभिक्रिया में बहुत कम मात्रा में नाइट्रो एथेन भी बनता है।
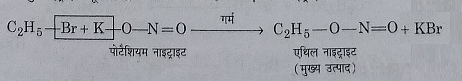
17: सिल्वर नाइट्राइट के साथ अभिक्रिया: एथिल ब्रोमाइड पर सिल्वर नाइट्राइट की अभिक्रिया के द्वारा नाइट्रो एथेन बनता है।
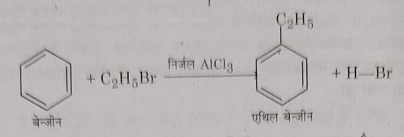
18: बेंजीन के साथ अभिक्रिया: बेंजीन को एथिल ब्रोमाइड के साथ निर्जल एल्युमिनियम क्लोराइड की उपस्थिति में गर्म करने पर एथिल बेंजीन बनते हैं ।यह अभिक्रिया फ्रिडल क्राफ्ट अभिक्रिया का एक उदाहरण है।
उपयोग: इसके प्रयोग निम्नलिखित हैं
1: स्थानीय निश्चेतक के रूप में
2: विभिन्न प्रकार की कार्बनिक यौगिकों के संश्लेषण में
डाईहेलोएल्केन जैसे डाईक्लोरोमेथेन , जैम- डाईहैलाइड और विस- डाईहैलाइड
डाईहेलोएल्केन: इनमें प्रमुख योगिक निम्नलिखित हैं:
- डाईक्लोरोमेथेन
- जैम- डाईहैलाइड
- विस- डाईहैलाइड
डाईक्लोरोमेथेन और इसकी निर्माण विधियां
निर्माण विधियां : इसे निम्न विधियों द्वारा बनाया जा सकता है:
1: औद्योगिक निर्माण: बड़े पैमाने पर दी डाईक्लोरोमेथेन का निर्माण करने के लिए मेंथेन का क्लोरीनीकरण किया जाता है जिससे चार हेलोएल्केन यौगिको का मिश्रण प्राप्त होता है। जिनका प्रभाजी आसवन करने पर डाईक्लोरोमेथेन पृथक हो जाता है।
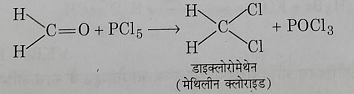
2: फॉर्मलडिहाइड से: फॉर्मलडिहाइड की PCl5 से अभिक्रिया करने पर डाईक्लोरोमेथेन प्राप्त होता है।
3: क्लोरोफॉर्म से: क्लोरोफॉर्म का जिंक व तनु हाइड्रोक्लोरिक अम्ल द्वारा अपचयन करने पर डाईक्लोरोमेथेन प्राप्त होता है।

डाईक्लोरोमेथेन के भौतिक और रासायनिक गुण
गुण:
1: डाईक्लोरोमेथेन एक मीठी गंध वाला रंगहीन वाष्पशील द्रव है ।
2: इसका क्वथनांक 313 केल्विन है।
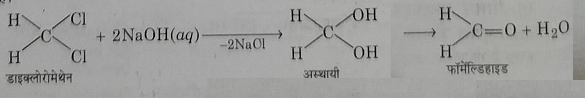
3: कास्टिक क्षारो से अभिक्रिया: यह अत्यधिक अभिक्रियाशील योगिक है जो कास्टिक क्षारो के तनु विलियनों द्वारा अपघटित होने पर फॉर्मलडिहाइड देता है।
4: मैलोनिक एस्टर के मोनोसोडियम लवण से अभिक्रिया: डाईक्लोरोमेथेन मैलोनिक एस्टर के मोनोसोडियम लवण के साथ अभिक्रिया करके प्रोपेन देता है।
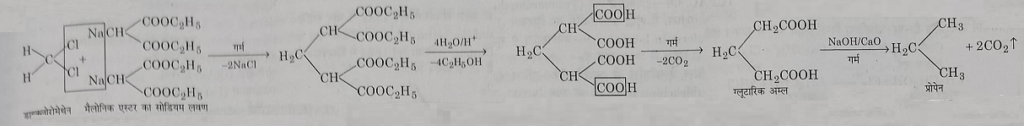
डाईक्लोरोमेथेन के उपयोग और हानिकारक प्रभाव
उपयोग: इसके सामान्यत: निम्नलिखित उपयोग हैं:
1: इसका उपयोग खाद्य तथा दवाइयां में विलायक के रूप में किया जाता है।
2: यह पेंट हटाने तथा एरोसोल में प्रोपेलेंट के रूप में प्रयोग किया जाता है।
3: यह औषधि निर्माण में विलायक के रूप में प्रयुक्त होती है।
4: यह धातु की सफाई एवं फिनिशिंग विलायक के रूप में प्रयुक्त होता है।
हानिकारक प्रभाव:
1: यह मनुष्य के केंद्रीय तंत्रिका तंत्र के लिए हानिकारक होती है।
2: इसकी वायु में अधिक मात्रा के कारण चक्कर आना, मितली, हाथ पैरों की उंगलियों में सनसनी एवं जड़ता, आदि लक्षण उत्पन्न हो जाते हैं।
3: इसके प्रभाव से त्वचा पर तीव्र जलन तथा हल्का लालपन आ जाता है।
4: यह आंखों की कार्निया को जला सकता है।
जेम - डाईहैलाइड और इसकी बनाने की विधियां
जेम – डाईहैलाइड: वे डाईहैलाइड जिनमें दोनों हैलोजन एल्किल समूह के एक कार्बन परमाणु पर बंधित होते हैं जेम डाईहैलाइड कहलाते हैं।
बनाने की विधियां: इन्हें अनेक प्रकार से बनाया जा सकता है :
1: एल्काइन पर हैलोजन अम्लों के योग द्वारा: जब एल्काइन पर हैलोजन अम्लो की अभिक्रिया कराई जाती है तो जेम डाईहैलाइड प्राप्त होते हैं।

2: एल्डिहाइडो या कीटोनों पर फास्फोरस पेंटाक्लोराइड या फास्फोरस पेंटा ब्रोमाइड की अभिक्रिया द्वारा:
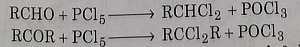
जेम - डाईहैलाइड के भौतिक और रासायनिक गुण
गुण:
भौतिक गुण :
1: इस श्रेणी के निम्न सदस्य मीठी गंध वाले रंगहीन गैस व द्रव होते हैं जबकि उच्च सदस्य ठोस होते हैं।
2: यह जल में अविलय है किंतु कार्बनिक विलायकों में विलय होते हैं।
3: एल्किल हेलाइड की तुलना में इनकी क्रियाशीलता कम होती है।
रासायनिक गुण :
1: ताप का प्रभाव : यह गर्म करने पर एल्किन हेलाइड में उपद्घाटित हो जाता है।
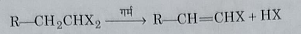
2: जल अपघटन : यह जलीय विलियन पोटैशियम हाइड्रोक्साइड या सोडियम हाइड्रोक्साइड द्वारा अब घटित होकर एल्डिहाइड या कीटोन बनाते हैं।
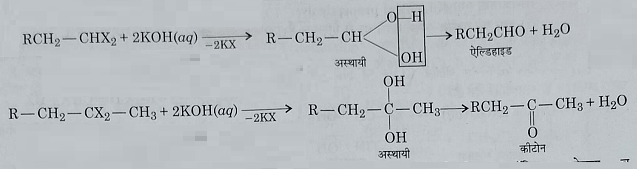
3: विहाइड्रो हैलोजनीकरण: एल्कोहलिक कास्टिक पोटाश, व सोडामाइड के साथ गर्म करने पर एल्काइन बनाते हैं।
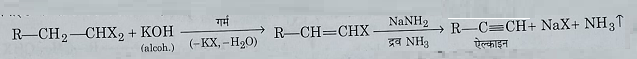
4: वि- हैलोजनीकरण: जिंक चूर्ण के साथ मेथिल एल्कोहल की उपस्थिति में गर्म करने पर जैम डाइहैलाइड, एल्किन देते हैं।
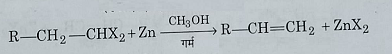
5: KCN के साथ अभिक्रिया : पोटेशियम साइनाइड के साथ अभिक्रिया तथा फिर जल अपघटन करने पर यह निम्न प्रकार अभिक्रिया देता है:
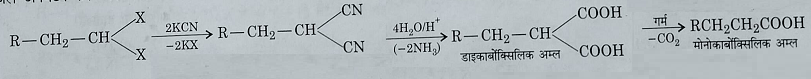
जेम - डाईहैलाइड के उपयोग
उपयोग : इसके प्रयोग निम्नलिखित है:
1: एल्डिहाइड में कीटोन आदि के निर्माण में।
2: एल्किन में एल्काइन के निर्माण में।
3: अनेक कार्बनिक यौगिकों के निर्माण में।
इस chapter के सभी भाग
विस - डाइहैलाइड और इसकी बनाने की विधियां
विस – डाइहैलाइड: वे डाइहैलाइड जिसमे दो हैलोजन परमाणु एल्किन समूह के दो पड़ोसी कार्बन परमाणु पर आबंधित रहते हैं विस डाइहैलाइड कहलाते हैं।
बनाने की विधियां : इनका निर्माण निम्न प्रकार से किया जा सकता है:
1: एल्किनो पर हैलोजन के योग द्वारा: साधारण ताप पर एल्किन व हैलोजन की अभिक्रिया से विस डाइहैलाइड बनते हैं।
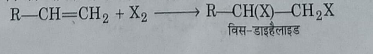
2: ग्लाइकोल पर फास्फोरस पेंटा क्लोराइड व पेंटा ब्रोमाइड की अभिक्रिया द्वारा:
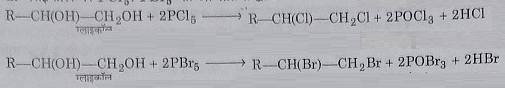
विस - डाइहैलाइड के भौतिक और रासायनिक गुण
भौतिक गुण:
1: इस श्रेणी के निम्न सदस्य द्रव, उच्च सदस्य ठोस होते हैं।
2: सामान्यत: इनके क्वथनांक संगत मोनो हैलोजनों व्युत्पन्न से उच्च होते हैं।
3: इनकी क्रियाशीलता एल्कील हेलाइड के लगभग समान होती है।
रासायनिक गुण:
1: ताप का प्रभाव: गर्म करने पर यह एल्कील हेलाइड में उपद्घाटित हो जाते हैं।
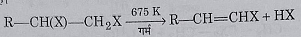
2: जल अपघटन: यह जलीय पोटैशियम हाइड्रोक्साइड या सोडियम हाइड्रोक्साइड विलियन द्वारा जल अपघटन करने पर ग्लाइकोल बनाते हैं।
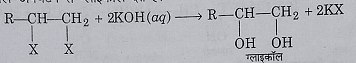
3: वि- हाइड्रोहैलोजनीकरण: अल्कोहलिक पोटैशियम हाइड्रोक्साइड और NaNH2 के साथ गर्म करने पर एल्काइन बनाते हैं।
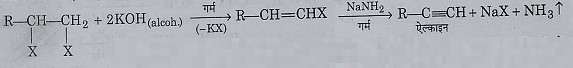
4: वि- हैलोजनीकरण: जिंक चूर्ण के साथ मेथिल एल्कोहल की उपस्थिति में गर्म करने पर एल्किन बनाते हैं।
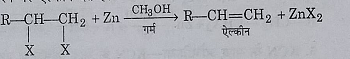
5: KCN के साथ अभिक्रिया: पोटेशियम साइनाइड के साथ अभिक्रिया करने के उपरांत जल अपघटन करने पर यह निम्न प्रकार अभिक्रिया देते हैं:
विस - डाइहैलाइड के उपयोग
उपयोग: इसके प्रयोग निम्नलिखित हैं:
1: एल्किन, एल्काइनो के निर्माण में।
2: ग्लाइकोल के निर्माण में।
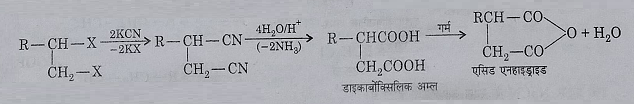
3: डाइकार्बोक्सिलिक अम्ल के निर्माण में।
ट्राई हेलो एल्केन और हेलोफॉर्म
ट्राई हेलो एल्केन: जब एल्केन में से तीन हाइड्रोजन परमाणु को तीन हैलोजन परमाणु द्वारा प्रतिस्थापित कर दिया जाता है तो व्युत्पन्न यौगिक ट्राई हेलो एल्केन या ट्राई हैलोजन व्युत्पन्न कहलाता है।
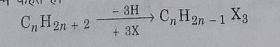
इनमें मेंथेन के ट्राई हैलोजन व्युत्पन्न हेलोफॉर्म कहलाते हैं।

इनमें से प्रमुख योगिक निम्नलिखित हैं:
1: क्लोरोफॉर्म
2: आयोड़ोंफॉर्म
क्लोरोफॉर्म और इसकी निर्माण विधियां
क्लोरोफॉर्म: इसकी खोज सर्वप्रथम सन 1831 में वोन लीबिग तथा यूजीन सोबेरन ने की थी। और इसका नाम क्लोरोफॉर्म जिन बैप्टिस्ट ड्यूमास ने दिया था। सन 1884 में सिंपसन ने इसके निश्चेतक गुणों का अध्ययन किया ।
सूत्र: CHCl3
IUPAC नाम: ट्राई क्लोरोमेथेन
1: प्रयोगशाला में शुद्ध क्लोरोफॉर्म का निर्माण: प्रयोगशाला में शुद्ध क्लोरोफॉर्म का निर्माण निम्न दो प्रकार से किया जा सकता है:
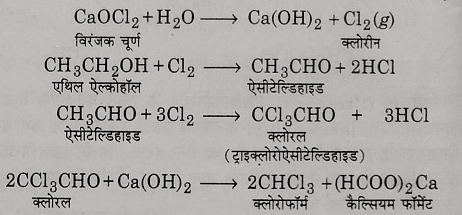
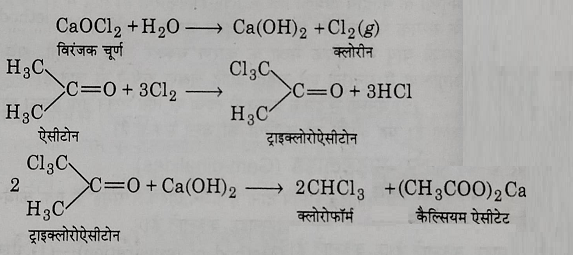
अ) एथिल एल्कोहल से क्लोरोफॉर्म का निर्माण: एथिल एल्कोहल को नम विरंजक चूर्ण के साथ मिलाकर आसवन करने पर क्लोरोफॉर्म प्राप्त होता है यह अभिक्रिया निम्न पदों में संपन्न होती है:
ब) एसीटोन से क्लोरोफॉर्म का निर्माण: एसीटोन का नम विरंजक चूर्ण के साथ आसवन करने पर भी क्लोरोफॉर्म बनता है और यह अभिक्रिया निम्न पदों में संपन्न होती है:
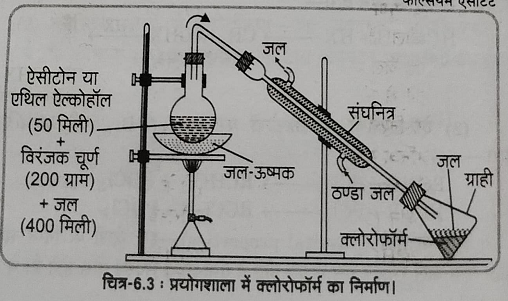
क्रियाविधि: चित्र अनुसार एक गोल पेंदी के फ्लास्क में 200 ग्राम विरंजक चूर्ण की 400 ml जल से बनी लेई और 50 ml एसीटोन या एथिल एल्कोहल लेकर जल उष्मक के साथ गर्म करते हैं जिससे जल तथा क्लोरोफॉर्म का मिश्रण अश्वित होकर जल से भरे ग्रही पात्र में इकट्ठा हो जाता है।
पृथक्कारी कीप द्वारा आसुत द्रव का नीचे वाला अंश एकत्रित कर लिया जाता है और अम्लीय अशुद्धियो को दूर करने के लिए सोडियम हाइड्रोक्साइड विलियन द्वारा धोकर फिर जल से धोकर इसमें निर्जल कैल्शियम क्लोराइड मिलाकर पुन: आसवित करते हैं जिससे लगभग 61 डिग्री सेल्सियस पर शुद्ध क्लोरोफॉर्म प्राप्त होता है|
2: क्लोरल से क्लोरोफॉर्म का निर्माण: क्लोरल को कास्टिक सोडा विलयन के साथ आसवान करने पर शुद्ध क्लोरोफॉर्म प्राप्त होते हैं।
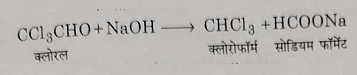
3: औद्योगिक निर्माण: क्लोरोफॉर्म का औद्योगिक निर्माण करने के लिए एथिल एल्कोहल युक्त सोडियम क्लोराइड विलियन का विद्युत अपघटन किया जाता है ।

क्लोरोफॉर्म के भौतिक और रासायनिक गुण
भौतिक गुण:
1: यह एक रंगहीन मीठी गंध वाला वाष्पशील द्रव होता है।
2: इसका क्वथनांक 61 डिग्री सेल्सियस होता है।
3: इसका आपेक्षिक घनत्व 1.485 होता है।
4: यह जल में अविलय किंतु ईथर व एल्कोहल में विलय होता है।
5: इसकी वाष्प को सूंघने से कुछ समय के पश्चात मूर्छा आ जाती है। इसी कारण इसका उपयोग निश्चेतक के रूप में किया जाता है।
रासायनिक गुण:
1: ऑक्सीकरण: सूर्य के प्रकाश तथा वायु में खुला रखने पर फास्जिन या कार्बोनिल क्लोराइड गैस बनती है। जो की एक विषैली गैस है।

यही कारण है कि क्लोरोफॉर्म को गहरे भूरे रंग की बोतल में ऊपर तक भरकर रखा जाता है जिसे प्रकाश और वायु अंदर तक न पहुंच सके।
2: अपचयन: यह जिंक और जल के साथ उबालने पर अपचयन होकर मेथेन देता है। जबकि जिंक और तनु हाइड्रोक्लोरिक अम्ल के साथ अपचयन करने पर मैथिलीन क्लोराइड और जिंक व एल्कोहलिक हाइड्रोक्लोरिक अम्ल द्वारा अपचयन करने पर मैथिल क्लोराइड बनता है।

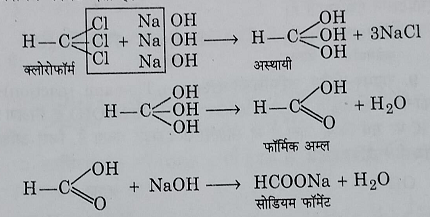
3: क्षारीय अपघटन: यह कास्टिक क्षारो के साथ तनु विलयन के साथ गर्म करने पर जल अपघटित हो जाता है जिसके फलस्वरुप सोडियम फॉर्मेट या पोटेशियम फॉर्मेट बनता है।
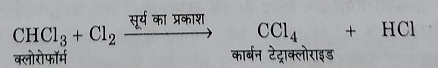
4: क्लोरीन से अभिक्रिया: यह क्लोरीन से अभिक्रिया करके टेट्राक्लोराइड बनता है।
5: एसीटोन से अभिक्रिया: यह क्षार की उपस्थिति में एसीटोन से संघनन अभिक्रिया करके क्लोरोटोन बनाता है जिसका उपयोग निद्राकारी औषधि के रूप में होता है।
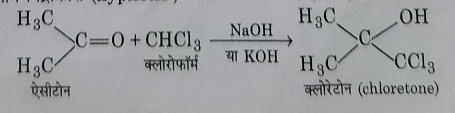
6: नाइट्रिक अम्ल से अभिक्रिया: यह नाइट्रिक अम्ल से अभिक्रिया करके नाइट्रो क्लोरोफॉर्म बनता है जिसका उपयोग कीटनाशक वह अश्रु गैस के रूप में होता है।
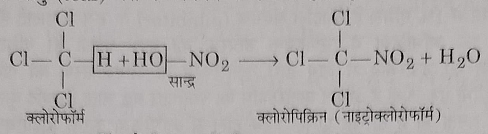
कार्बीलएमीन अभिक्रिया और राइमर टीमैन अभिक्रिया
7: कार्बीलएमीन अभिक्रिया: क्लोरोफॉर्म को प्राथमिक एमीन और एल्कोहलिक पोटेशियम हाइड्रोक्साइड के साथ गर्म करने पर दुर्गंध युक्त पदार्थ आइसोसायनाइड बनता है जिसे कार्बीलएमीन के नाम से जाना जाता है। इस कारण यह अभिक्रिया कार्बीलएमीन अभिक्रिया के नाम से जानी जाती है।
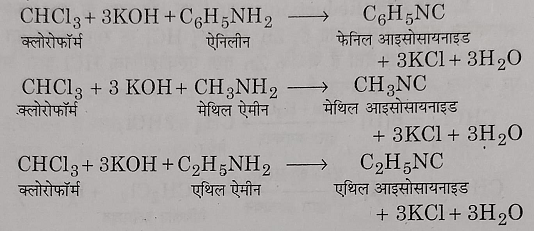
इस परीक्षण को आइसोसायनाइड परीक्षण भी कहते हैं यह परीक्षण प्राथमिक एमीन तथा क्लोरोफॉर्म दोनों देते हैं।
8: चांदी के चूर्ण के साथ अभिक्रिया: क्लोरोफॉर्म को रजत चूर्ण के साथ गर्म करने पर वि – हैलोजनीकरण से एसिटिलीन गैस प्राप्त होती है।
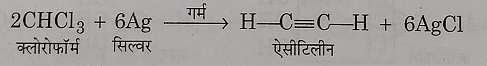
9: राइमर टीमैन अभिक्रिया: इस अभिक्रिया में फिनोल, क्लोरोफॉर्म और एल्कोहलिक पोटेशियम हाइड्रोक्साइड या सोडियम हाइड्रोक्साइड के मिश्रण को 340 k पर गर्म किया जाता है जिसके फलस्वरुप सैलिसिल एल्डिहाइड बनता है जिसे ऑर्थो हाइड्रोक्सीबेंजीन एल्डिहाइड भी कहते हैं।
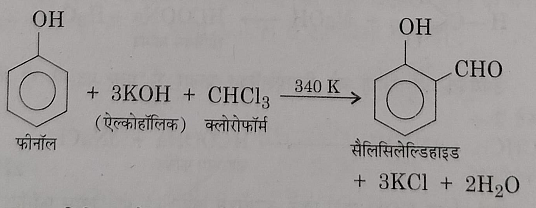
इस अभिक्रिया को राइमर टीमैन अभिक्रिया कहते हैं इसमें कुछ मात्रा में p समावयवी भी बनता है।
क्लोरोफॉर्म के उपयोग और शुद्ध क्लोरोफॉर्म परीक्षण
उपयोग: इसके प्रयोग निम्नलिखित है।
1: 30% इधर में इसका विलियन शल्य चिकित्सा में निश्चेतक के रूप में प्रयुक्त होता है परंतु अब इसके स्थान पर इधर प्रयुक्त होने लगा हैं।
2: लाख, रबर , चर्बी , वसा, एल्कलॉइड आयोडीन आदि के लिए विलय के रूप में।
3: दवाइयां के रूप में।
4: जीवाणु नाशक के रूप में।
5: सुगंधित पदार्थ के रूप में।
6: वर्तमान में इसका उपयोग फ्रीऑन प्रतिशत तक r-22 बनाने में होता है।
7: टेफलॉन के निर्माण में।
शुद्ध क्लोरोफॉर्म परीक्षण:
1: यदि क्लोरोफॉर्म को एनिलीन और एल्कोहलिक KOH के साथ गर्म करने पर दुर्गंध आती है तो यह शुद्ध होती है।
2: शुद्ध क्लोरोफॉर्म सिल्वर नाइट्रेट विलयन के साथ अवक्षेप नहीं देता है।
3: क्लोरोफॉर्म की वाष्प कॉपर के तार की सहायता से परीक्षण में हरी लौ के साथ जलती है।
आयोड़ोंफार्म और इसकी निर्माण विधियां
आयोड़ोंफार्म:
सूत्र : CHI3
IUPAC नाम : ट्राई आयोडो मेथेन
निर्माण विधियां :
1: प्रयोगशाला विधि: प्रयोगशाला में इसका निर्माण क्षार की उपस्थिति में आयोडीन की एल्कोहल या एसीटोन से अभिक्रिया करके किया जाता है यह अभिक्रिया हेलोफार्म अभिक्रिया के नाम से जानी जाती है।
1: एथिल एल्कोहल से:

2: एसीटोन से:

आयोड़ोंफार्म के भौतिक और रासायनिक गुण
भौतिक गुण:
1: यह गहरे पीले रंग का ठोस पदार्थ होता है जिसका क्वथनांक 392 केल्विन होता है।
2: इसमें एक विशेष प्रकार की अरुचिकर गंध होती है।
3: यह जल में अविलेय है परंतु कार्बनिक विलायकों में विलय होती है।
4: इसमें C-I आबंध कम स्थाई होता है इसलिए यह प्रकाश तथा वायु में खुला रखने पर मंद गति से विघटित हो जाती है और आयोडीन मुक्त करती है। इसी कारण यह है सिल्वर नाइट्रेट विलयन के साथ अभिक्रिया करने पर सिल्वर आयोडाइड का पीला अवक्षेप देता है।
रासायनिक गुण:
1: अपचयन: यह अपचायित होकर मैथिलीन आयोडाइड बनाता है।

2: क्षारीय जल अपघटन: जब इसका क्षारीय जल अपघटन किया जाता है तो फॉर्मेट लवण बनता है।

3: कार्बीलएमीन अभिक्रिया: यह भी कार्बीलएमीन अभिक्रिया देती है जिसके फलस्वरुप आइसोसायनाइड बनता है।

4: ऊष्मा का प्रभाव: इसे गर्म करने पर आयोडीन की बैंगनी रंग की वाष्प निकलती है।
आयोड़ोंफार्म के उपयोग
उपयोग: इसके प्रयोग निम्नलिखित है:
1: प्राथमिक एमीनो के प्रशिक्षण में
2: एसिटिलीन के निर्माण में
3: पूर्ति रोधी के रूप में












